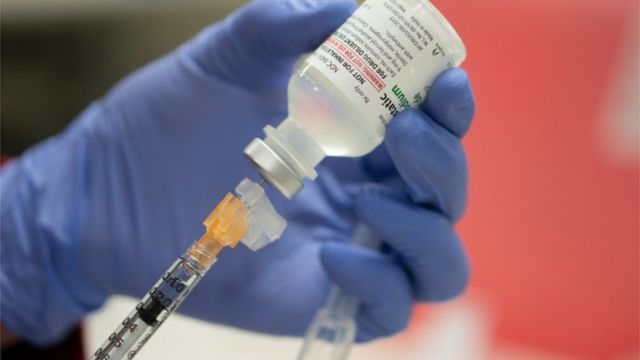
Especialistas que assessoram a agência sanitária americana, a Food and Drug Administratin (FDA), recomendaram nesta quinta-feira (10/11) a aprovação emergencial da vacina contra o coronavírus produzida pelas farmacêuticas Pfizer-BioNTech.
A decisão é resultado de um encontro que reuniu 23 consultores, cuja pauta era avaliar se os benefícios da vacina superam os riscos.
A vacina da Pfizer-BioNTech já foi aprovada para uso do público no Reino Unido, Canadá, Bahrein e Arábia Saudita.
O tratamento ainda precisa ser aprovado formalmente pela direção do FDA, o que é esperado para os próximos dias.
A recomendação do comitê vem um dia depois de os Estados Unidos registrarem mais de 3 mil mortes nas últimas 24 horas — o maior número de óbitos em um dia já documentado no mundo.
Alex Azar, secretário de saúde dos EUA, disse na quarta-feira que, depois da reunião, “poderíamos ter uma vacina em poucos dias e fornecê-la aos mais vulneráveis na próxima semana”.
A Operação Warp Speed, o programa de distribuição de vacinas do governo federal americano, prevê que as entregas das doses podem começar dentro de 24 horas após a aprovação.
A Pfizer planeja ter 6,4 milhões de doses prontas para os EUA em sua primeira rodada, no final de dezembro; como são necessárias duas injeções por pessoa, isso é suficiente para três milhões de pessoas. A população total dos EUA é de 330 milhões.
Representantes dos Centros de Controle e Prevenção de Doenças (CDC) dizem que os 21 milhões de trabalhadores de saúde do país devem ser priorizados, assim como os 3 milhões de idosos vivendo em asilos.
Mas há mais dúvidas sobre como deve ser a distribuição nos Estados para outros grupos, que não estão sob alto risco — cuja imunização deve acontecer a partir do primeiro trimestre de 2021.
Uma segunda vacina, desenvolvida pela farmacêutica Moderna, também está tendo aprovação emergencial avaliada nos EUA. Como a vacina Pfizer, ela requer duas doses por pessoa.
Fonte: BBC News




















Comentários