O estudo buscou com compreender a interação do veneno com o complexo respiratório.
Povos originários da Amazônia extraem a rotenona de plantas e cipós há centenas de anos. Fatal para qualquer animal, interrompendo a produção de energia das células, essa substância é despejada nos rios em rituais de pesca coletiva para facilitar a captura dos peixes. Em artigo publicado recentemente, em colaboração com a Universidade de Cambridge (Reino Unido), pesquisadores do Instituto de Química (IQ) da USP esclareceram que a capacidade da rotenona de envenenar um animal depende da alternância entre as duas formas que uma mesma molécula dela assume.
Os peixes envenenados ficam agonizando como se estivessem fora d’água. “Em vez de pescar com flechas, que dá muito mais trabalho, os indígenas envenenam os peixes e passam uma cesta rio abaixo para pegá-los”, detalha o professor Guilherme Menegon Arantes, que liderou o grupo de pesquisa do Laboratório de Química, Bioquímica e Biofísica Computacionais. Após assados, os animais podem ser consumidos sem risco à saúde. “Eles tostam em brasa até quase torrá-los. Isso destrói a molécula de rotenona.”

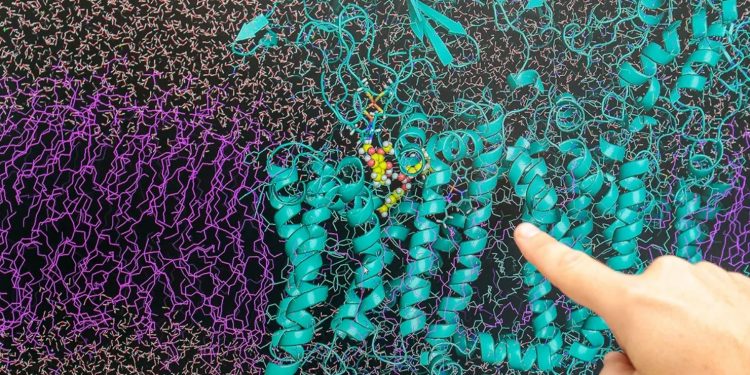
Com maior frequência, a molécula do veneno aparece dobrada, mas também se abre. Os cientistas descobriram que essa flexibilidade da rotenona permite sua passagem por um túnel estreito dentro do chamado complexo respiratório 1, proteína essencial na respiração celular. Os dados estão no artigo Mechanism of rotenone binding to respiratory complex I depends on ligand flexibility publicado na Scientific Reports. A compreensão detalhada obtida por modelos computacionais servirá para ajustar derivados sintéticos usados na agricultura e na saúde.
Respiração
O estudo buscou com compreender a interação do veneno com o complexo respiratório 1. Por ser impossível obter vídeos de moléculas tão pequenas, os cientistas fazem uma simulação digital tridimensional. Partindo das estruturas das proteínas paradas, criam uma espécie de filme dessas partículas minúsculas. A simulação deve conter detalhes como a posição dos átomos e a interação das substâncias.
Quanto mais substâncias químicas, como proteínas, gorduras, água e sal, e quanto mais fiéis elas são colocadas no computador, mais precisa é a representação do modelo. Em seguida, uma técnica de aceleração é aplicada, como conta Caroline Pereira, primeira autora do estudo publicado. “É basicamente calcular a força entre as moléculas e permitir que elas se mexam, fazendo da foto um filme ao longo do tempo.”

O veneno foi isolado pela primeira vez pelo botânico francês Emmanuel Geoffroy, em 1895. O conhecimento tradicional da rotenona foi, então, explorado e comercializado por indústrias químicas, resultando na produção de pesticidas amplamente utilizados na produção agrícola. Curiosamente, os alimentos tratados com rotenona são considerados orgânicos, porque o composto é de origem natural, embora nocivo.
Uma versão da molécula de rotenona travada no formato aberto foi sintetizada pelos cientistas. Embora consiga entrar no túnel, a molécula de laboratório não tem uma afinidade tão grande com as proteínas do interior do complexo quanto a forma dobrada.
Entendendo as biomoléculas
Dentro das células, os elétrons são transportados por uma cadeia de complexos formados por proteínas, liberando parte da energia em cada etapa. Quando a rotenona se liga ao complexo 1, consegue bloquear esse processo. Para passar pelo túnel de entrada, porém, ela precisa estar na forma aberta. No interior do túnel há mais espaço e a rotenona volta para a conformação dobrada, 600 vezes mais ativa. Assim, a molécula gruda mais facilmente na estrutura e tampa o túnel. Esse obstáculo impede o fluxo dos elétrons. “Alguns organismos com substitutos para o complexo 1 até conseguem sobreviver, mas são uma fração pequena das espécies”, ressalva Arantes.

Caroline Pereira explica que pesquisas anteriores não explicavam como o veneno interrompia o funcionamento do complexo 1: “nós conduzimos simulações da dinâmica molecular de ligação de rotenona e concluímos que a molécula se liga, principalmente, em três sítios ao longo do complexo 1. Essa atividade inibitória de produção de energia já era conhecida, mas somente nossas simulações mostraram como este processo molecular ocorre.”
Células cancerosas têm o metabolismo alterado e poderiam ser combatidas através da inibição por rotenona. Por isso, hoje são realizadas pesquisas sobre o potencial desse composto como anticancerígeno em terapias combinadas com outras drogas.
Nobel de Química
A tecnologia computacional utilizada na pesquisa foi criada pelos vencedores do Nobel de Química em 2013, Arieh Warshel, Martin Karplus e Michael Levitt. Estudos de dois dos cinco complexos de transporte de elétrons também já foram agraciados com o Prêmio Nobel. “Provavelmente quem entender um pouco mais o complexo 1 vai ganhar um Nobel também”, opina o professor, que torce por uma colega. “Pode vir para a Judy Hirst, coautora do nosso artigo!”. Judy é professora de química biológica da Universidade de Cambridge.
Otto Gottlieb, um dos dois únicos cientistas do Brasil indicado a um Prêmio Nobel de Química, concorreu nessa modalidade em 1999 justamente por investigar a biodiversidade das florestas brasileiras do ponto de vista químico. Nascido na Checoslováquia e naturalizado brasileiro, ele foi professor do Instituto de Química (IQ) da USP de 1967 a 1990.
O conhecimento dos povos nativos da Amazônia já demonstra na prática a natureza extraordinária da rotenona. A nova visão molecular obtida pelos cientistas mostra que este produto natural vai além das características físicas e químicas mais comuns. “A rotenona, aparentemente uma molécula rígida por causa dos cinco anéis fundidos, na verdade tem uma flexibilidade. São duas ‘identidades’. Sozinhas, nenhuma das duas se ligaria ao complexo 1 com a mesma eficiência e estabilidade”, explica Arantes.
Mais informações: e-mail [email protected], com Guilherme Menegon Arantes
Fonte: Jornal da USP



















Comentários