A enzima asparaginase, que é a base de medicamentos que tratam a leucemia linfoide aguda (LLA), foi melhorada e causa menos irritação ao sistema imune dos pacientes.

Um grupo de cientistas da Faculdade de Ciências Farmacêuticas (FCF) da USP conseguiu produzir em laboratório uma asparaginase menos agressiva ao sistema imune de pacientes portadores de leucemia linfoide aguda (LLA). “A asparaginase é uma enzima usada na composição de medicamentos destinados ao tratamento desse tipo de câncer, que atinge principalmente crianças e adolescentes”, explica a professora Gisele Monteiro, do Departamento de Tecnologia Bioquímico-Farmacêutica da FCF.
Segundo a pesquisadora, apesar de eficientes, os medicamentos para o tratamento da LLA podem causar efeitos que irritam o sistema imune. “Em alguns casos, podem provocar choque anafilático ou necessitar a interrupção do seu uso no tratamento”, ressalta a docente. O trabalho dos pesquisadores resultou no artigo Influence of lysosomal protease sensitivity in the immunogenicity of the antitumor biopharmaceutical asparaginase, publicado na Biochemical Pharmacology, no final de 2020.
A pesquisa mostra que existe a possibilidade de o Brasil produzir a asparaginase menos danosa ao sistema imune contra a LLA. Isso poderia tornar o País independente na produção da enzima, o que possibilitaria também um medicamento mais barato. “Mesmo que o medicamento não venha a ser produzido por aqui, poderemos exportar essa tecnologia”, pondera Gisele, lembrando que a asparaginase é o ingrediente farmacêutico ativo em medicamentos para tratar a LLA usados em todo o mundo.
“No tratamento da LLA, as chances de cura são de 80% e 90%. Mas, se for interrompido, a doença será fatal; somente 20% dessas crianças irão sobreviver. E, no Brasil, temos cerca de 10 mil casos por ano.”
Os medicamentos destinados ao tratamento da LLA são importados e custeados pelo Sistema Único de Saúde (SUS). Segundo Gisele, o medicamento mais administrado atualmente é o Oncaspar. Ele é composto de asparaginase peguilada que resulta de uma técnica bastante usada na indústria farmacêutica. “É uma forma de estabilizar a enzima usando ligação química com o polietilenoglicol (PEG) – técnica chamada peguilação”, descreve Gisele ao Jornal da USP. Mas a pesquisadora destaca que a técnica encarece o processo de produção. O Oncaspar foi recentemente aprovado e autorizado pela Agência Nacional de Vigilância Sanitária (Anvisa) e tem um custo médio de US$ 1 mil a dose.

Nos estudos coordenados por Gisele, além de reduzir a agressividade da asparaginase ao sistema imune, os cientistas também demostram que é possível desenvolver tecnologia 100% nacional para a obtenção de uma enzima menos agressiva. “A asparaginase sem peguilhar também é importada e relativamente cara”, lembra Gisele.

Gisele coordena um grupo de cientistas nos estudos e conta com o apoio da Fundação de Amparo à Pesquisa do Estado de São Paulo (Fapesp), que ela considera fundamental. “No tratamento da LLA, as chances de cura são de 80% a 90%. Mas, se for interrompido, a doença será fatal; somente 20% dessas crianças irão sobreviver. E, no Brasil, temos cerca de 10 mil casos por ano”, estima Iris Munhoz Costa, doutoranda do Departamento de Tecnologia Bioquímico-Farmacêutica da FCF e uma das principais autoras do artigo, ressaltando que a irritação ao sistema imune é uma das principais causas de interrupção do tratamento.
Mil clones
Utilizando técnicas de engenharia genética, os pesquisadores conseguiram então melhorar a asparaginase obtida da bactéria Escherichia coli. “A asparaginase é encontrada em grande parte das bactérias, mas a E. coli produz um tipo da enzima que é capaz de matar o câncer”, descreve a pesquisadora.
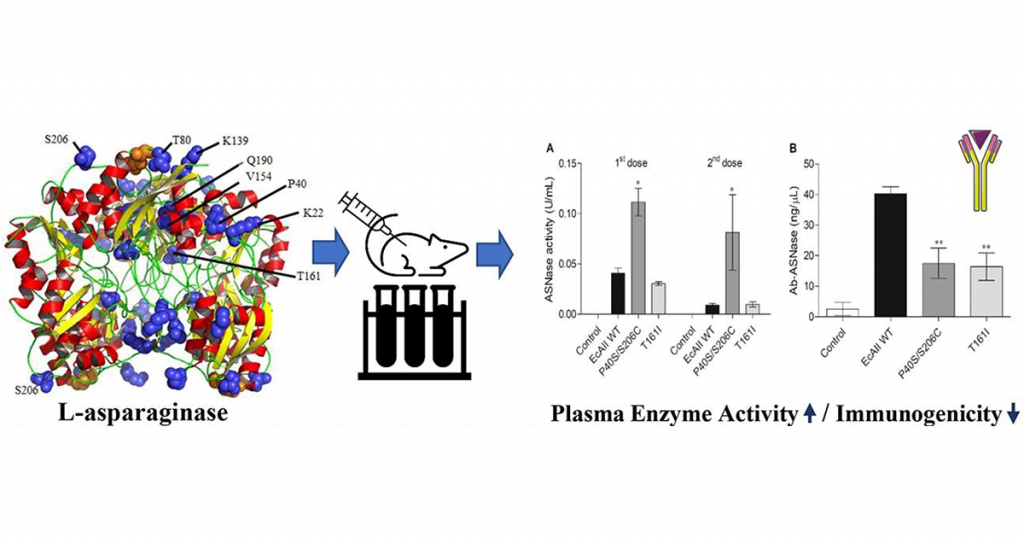
O trabalho envolveu análises do DNA da E. coli, que produz uma boa asparaginase mas que, ao mesmo tempo, é capaz de irritar o sistema imune humano. “A partir daí, foram inseridas mutações que causaram diversidade genética e resultaram em mais de mil clones da enzima”, conta Gisele ao Jornal da USP. Dos mil clones, seis foram selecionados por não perderem sua atividade. “Foram os seis clones que mantiveram a principal atividade, que é se aproveitar da deficiência natural das células tumorais na síntese de asparagina”, explica a pesquisadora.
Como já é do saber científico, no sangue humano existem proteases (enzimas capazes de quebrar ligações peptídicas entre os aminoácidos) que quebram a asparaginase expondo as regiões que são reconhecidas pelo sistema imune. “Dos seis clones que mantiveram atividade tumoral, descobrimos dois resistentes e, consequentemente, menos irritantes ao sistema imune”, descreve Iris, lembrando que vários experimentos foram realizados com camundongos.
Dos seis clones que mantiveram atividade tumoral, descobrimos dois resistentes e, consequentemente, menos irritantes ao sistema imune.
A iniciativa coordenada pela professora Gisele envolveu pesquisadores da Universidade de Campinas (Unicamp), Universidade Estadual Paulista (Unesp) e do Instituto de Ciências Biomédicas (ICB) da USP. O início foi em 2014 e a publicação no ano passado.
Fonte: Jornal da USP




















Comentários